1、 简介
转化生长因子-β(TGF-β)为分泌多肽生长因子家族的原型分子[1],其家族由哺乳动物的33个基因编码,通过调控细胞增殖、分化、迁移及凋亡过程,以参与机体稳态调节[2-4]。根据不同的结构和功能特征,可分为两大亚群,经典的TGF-β亚家族(包括TGF-β1、TGF-β2、TGF-β3、激活素A/B、Nodal及AMH等)以及骨形态发生蛋白(BMP)亚家族(包括各种生长分化因子GDFs等)[5]。
TGF-β1是TGF-β超家族中最具特征的亚型,其中在免疫细胞中表达最丰富、最广泛,是一种有效的纤维化细胞因子,可在几乎所有细胞中合成[6-7]。人TGF-β1的基因定位于染色体19q3,含有7个外显子,所编码的前体分子C端有9个保守的Cys,人和小鼠的TGF-β1的同源性高达99%,表明在不同种属中TGF-β1都具有重要的生物学功能[8-10]。不同物种TGF-β1蛋白的氨基酸序列非常稳定,无论是在人体内还是在动物体内,其功能都是相似的。TGF-β1是许多生物过程的关键调节因子,包括细胞和组织分化、血管生成、伤口愈合和免疫稳态[11-13]。
2、功能或作用机制
TGF-β1的激活
TGF-β1蛋白的体内合成为典型的前体蛋白加工模式,翻译产物通过信号肽进行引导并分泌表达,TGF-β1前体蛋白转运至高尔基体后,由前蛋白转化酶Furin特异性识别,并将其裂解成LAP和C端活性结构区域,两者进而产生特异性非共价稳定结合,并分泌至细胞外基质。此时结合物呈无活性状态。于整合素与LAP结合的作用下,进而释放TGF-β1,并触发后续信号级联反应[14-15]。
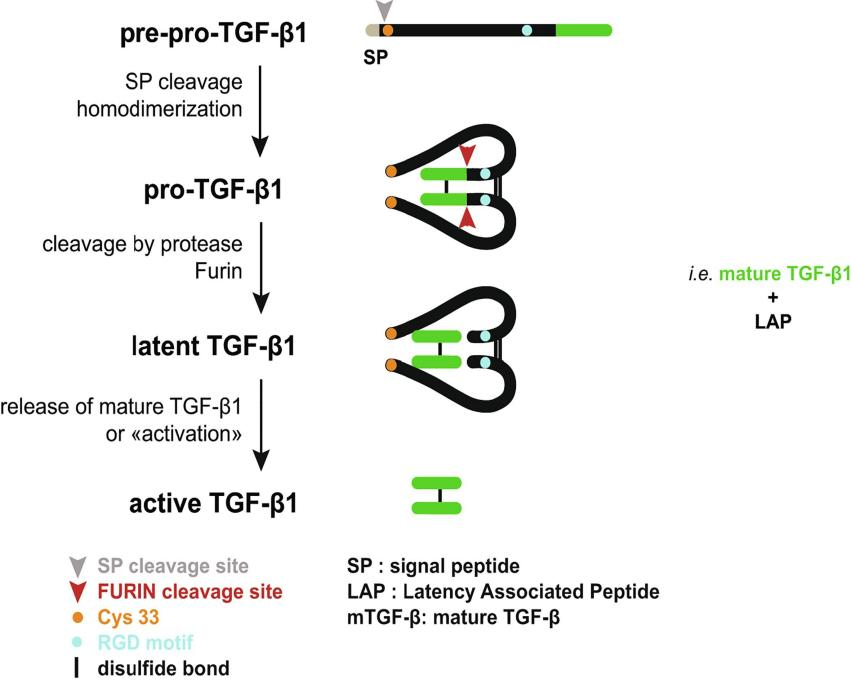
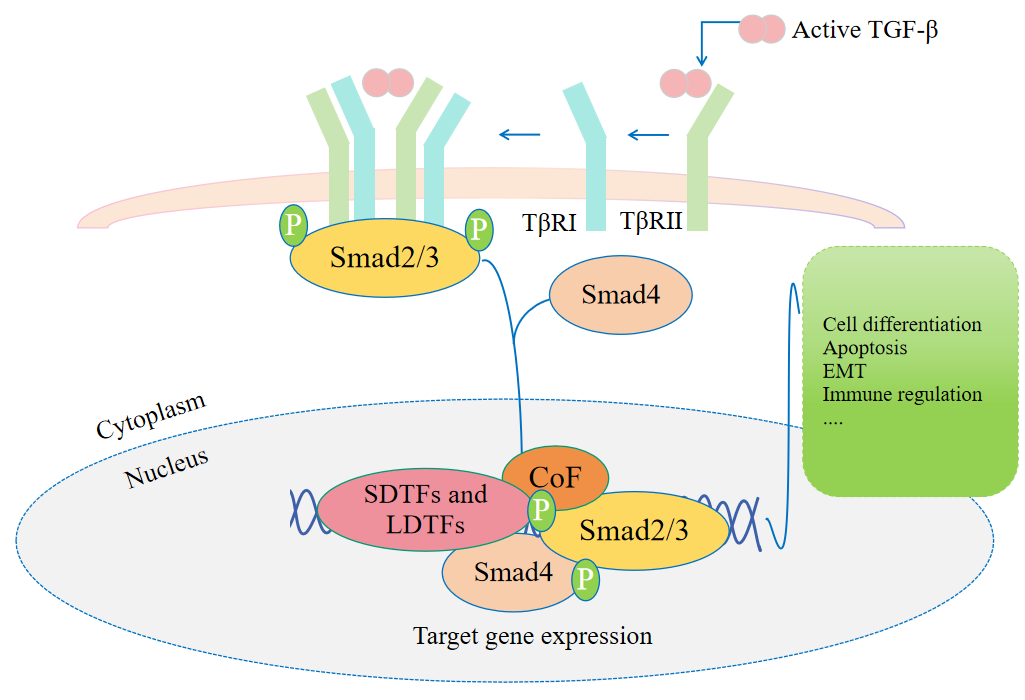
经典TGF-β/Smad信号转导
TGF-β的经典信号通路主要为受体依赖性R-Smad磷酸化的分子级联反应。该信号转导系统根据受体类型可分为:TGF-β1/2/3通路以及BMP通路。TGF-β1/2/3与BMP信号来源分别特异性激活Smad2/3和Smad1/5/8信号轴。其中TGF-β1/2/3激活典型的TGF-β通路受体,受体系统包含功能特化的三类跨膜蛋白:具有丝氨酸/苏氨酸激酶活性的Ⅰ型受体(TβRⅠ/ALK5)、Ⅱ型受体(TβRⅡ)和Ⅲ型受体(TβRⅢ/betalycan)。经典TGF-β信号传导中,配体首先通过结构特异性识别与TβRⅡ结合,诱导受体寡聚化并招募TβRⅠ形成异源四聚体复合物。TβRⅡ通过跨膜磷酸化级联激活TβRⅠ的激酶结构域,进而催化Smad2/3末端基序的丝氨酸残基双磷酸化。这一翻译后修饰触发R-Smad的构象重排,使其脱离受体复合物并与SDTFs、LDTFs、Smad4及CoF等因子于细胞核内形成多聚体转运复合体,进而调节靶基因表达。TGF-β调控多种基因表达,从而引发细胞分化、凋亡、上皮-间质转化(EMT)以及免疫调节等生物学过程[17-18]。
3、临床应用
1)创伤愈合
TGF-β1通过促进成纤维细胞的趋化,产生胶原纤维和细胞外基质,减少胶原酶的合成,增加金属蛋白酶抑制物TIMPs的产生,从而减少伤口中的酶解作用,促进细胞的增殖、迁移、分化,加速肉芽组织的形成,促进伤口愈合[19]。
2)腹膜纤维化
TGF-β1可致E-钙黏蛋白的基因和蛋白表达均下降,同时TGF-β1能上调α-SMA和CollagenI的表达,导致细胞间的黏附减弱,细胞运动迁移能力提高,并且向肌成纤维细胞转分化,可使细胞外基质过表达[20]。
3)心室重构
抑制成纤维细胞中c-Abl、血小板衍生生长因子受体-β及TGF-β1途径的磷酸化,而显著减少了SHR心脏中I型和III型胶原mRNA的表达,减轻心室重构并改善SHR模型左室舒张功能障碍,同时不产生降血压效果[21]。
4、相关产品
参考文献
[1] Sporn MB, Roberts AB. The transforming growth factor-betas: past, present, and future. Ann N Y Acad Sci. 1990;593:1-6.
[2] Derynck R, Budi EH. Specificity, versatility, and control of TGF-β family signaling. Sci Signal. 2019 Feb 26;12(570):eaav5183.
[3] Moses HL, Roberts AB, Derynck R. The Discovery and Early Days of TGF-β: A Historical Perspective. Cold Spring Harb Perspect Biol. 2016 Jul 1;8(7):a021865.
[4] Li MO, Flavell RA. TGF-beta: a master of all T cell trades. Cell. 2008 Aug 8;134(3):392-404.
[5] Hinck AP, Mueller TD, Springer TA. Structural Biology and Evolution of the TGF-β Family. Cold Spring Harb Perspect Biol. 2016 Dec 1;8(12):a022103.
[6] Santibañez JF, Quintanilla M, Bernabeu C. TGF-β/TGF-β receptor system and its role in physiological and pathological conditions. Clin Sci (Lond). 2011 Sep;121(6):233-51.
[7] Meng XM, Nikolic-Paterson DJ, Lan HY. TGF-β: the master regulator of fibrosis. Nat Rev Nephrol. 2016 Jun;12(6):325-38.
[8] Derynck R, Jarrett JA, Chen EY, Eaton DH, Bell JR, Assoian RK, Roberts AB, Sporn MB, Goeddel DV. Human transforming growth factor-beta complementary DNA sequence and expression in normal and transformed cells. Nature. 1985 Aug 22-28;316(6030):701-5.
[9] Hinck AP, Archer SJ, Qian SW, Roberts AB, Sporn MB, Weatherbee JA, Tsang ML, Lucas R, Zhang BL, Wenker J, Torchia DA. Transforming growth factor beta 1: three-dimensional structure in solution and comparison with the X-ray structure of transforminggrowth factor beta 2. Biochemistry. 1996 Jul 2;35(26):8517-34.
[10] Siegel PM, Massagué J. Cytostatic and apoptotic actions of TGF-beta in homeostasis and cancer. Nat Rev Cancer. 2003 Nov;3(11):807-21.
[11] Finnson KW, McLean S, Di Guglielmo GM, Philip A. Dynamics of Transforming Growth Factor Beta Signaling in Wound Healing and Scarring. Adv Wound Care (New Rochelle). 2013 Jun;2(5):195-214.
[12] 曹生军.TGF-β1诱导内皮细胞间质化促进血管新生的机制研究[D].苏州大学,2020.
[13] Travis MA, Sheppard D. TGF-β activation and function in immunity. Annu Rev Immunol. 2014;32:51-82.
[14] Shi M, Zhu J, Wang R, Chen X, Mi L, Walz T, Springer TA. Latent TGF-β structure and activation. Nature. 2011 Jun 15;474(7351):343-9.
[15] Mu D, Cambier S, Fjellbirkeland L, Baron JL, Munger JS, Kawakatsu H, Sheppard D, Broaddus VC, Nishimura SL. The integrin alpha(v)beta8 mediates epithelial homeostasis through MT1-MMP-dependent activation of TGF-beta1. J Cell Biol. 2002 Apr 29;157(3):493-507.
[16] de Streel G, Lucas S. Targeting immunosuppression by TGF-β1 for cancer immunotherapy. Biochem Pharmacol. 2021 Oct;192:114697.
[17] 文颖.天麻素调控TGF-β1/Smad2/3信号通路减轻高血压性肾脏纤维化的作用机制研究[D].福建中医药大学,2023.
[18] 张勇,秦娜,于斌.TGF-β/Smads信号转导通路的研究进展[J].广西医科大学学报,2009,26(01):155-157.
[19] Werner S, Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev. 2003 Jul;83(3):835-70.
[20] 张浩,刘伏友,刘映红,等.TGF-β1刺激对人腹膜间皮细胞内Smad信号转导通路的影响[J].中南大学学报(医学版),2004,(02):142-147.
[21] Travers JG, Kamal FA, Robbins J, Yutzey KE, Blaxall BC. Cardiac Fibrosis: The Fibroblast Awakens. Circ Res. 2016 Mar 18;118(6):1021-40.
[22] 袁明,李建华.转化生长因子β1与子痫前期的研究进展[J].解剖学杂志,2023.
[23] 柴文宇.TGF-β1、MTA联合应用对人牙髓干细胞增殖和分化的影响[D].河北医科大学,2022.
[24] 袁敏香.胃癌组织中p-AMPK与TGF-β1表达对转移及预后的影响[D].南昌大学,2023.
